癌蛋白KRAS的突变发生于约25%的癌症病例中,且与极差的疾病预后有关,因此,科学家们认为,阻断KRAS信号是一种潜在的抗癌途径。然而,先前几十年的研究证明,该蛋白可能是一种“无成药性”的靶点,因为,它的表面除了一个GTP结合口袋,其它部分非常光滑,因此,药物研发人员很难在其表面找到小分子候选药物的“立足点”(结合口袋)。
知识卡:在细胞内,KRAS与鸟苷二磷酸(GDP)结合时处于失活状态,与鸟苷三磷酸(GTP)结合时处于激活状态,而KRAS的异常激活与多种癌症密切相关。
不过,大约在10年前,研究人员发现,KRAS实际上比想象得更具靶向性,这使得研发靶向KRAS的药物取得了突破性的进展。如表1所示,至少有5种KRAS调节剂处于临床开发阶段。其中,AMG 510、MRTX849以及JNJ‑74699157/ARS-3248这三种候选药物仅靶向KRAS的G12C突变体(KRAS-G12C),而BI1701963(通过与SOS1结合来抑制KRAS)和mRNA-5671(靶向KRAS蛋白的一种癌症疫苗)有着不同的作用机制,可能在更广泛的人群中发挥作用。
知识卡:KRAS的失活与激活受两类因子的调节:1)鸟嘌呤核苷酸交换因子(GEF,如SOS蛋白),这类蛋白催化KRAS与GTP的结合,从而促进KRAS的激活;2)GTP酶激活蛋白(GTPase-activatingproteins,GAPs),这类蛋白能够促进与KRAS结合的GTP水解成为GDP,从而抑制KRAS的激活。
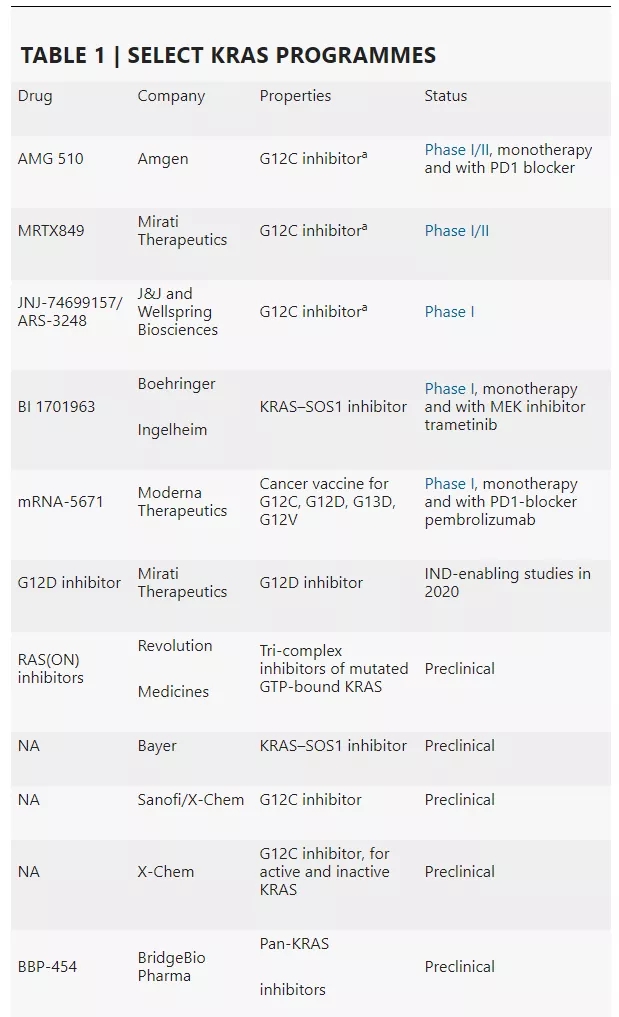
数据来源:Nature Reviews Drug Discovery
一、KRAS-G12C抑制剂
总体来说,KRAS抑制剂的进展与业界对“通过共价相互作用与靶点结合的小分子药物”的兴趣的提升紧密相关。先前很长一段时间,药物研发人员一直避免使用共价结合剂,因为他们担心这种混杂且不可逆的结合可能产生脱靶毒性。然而,随着EGFR抑制剂afatinib、BTK抑制剂ibrutinib等候选药物证实这种毒性是可控的,许多公司也开始探索这种共价结合剂是否也能适用于其它靶点。
加州大学旧金山分校的化学生物学家Kevan Shoka很早就发现了开发KRAS共价结合剂的可能性。因为,他们发现,KRAS-G12C突变体的特征是新引入一个半胱氨酸,而这种亲核氨基酸很容易形成共价键,如果一类小分子可共价结合KRAS-G12C突变体中的半胱氨酸,那么,它们就有望用于治疗携带这类KRAS突变的患者。
知识卡:G12C突变是最常见的KRAS突变之一,具体指KRAS 12位的甘氨酸(glycine)突变为半胱氨酸(cysteine)。该突变存在于约13%的肺腺癌中,3%的结直肠癌中以及2%的其它实体瘤中。其它常见的KRAS突变包括G12D、G12V,它们在结直肠癌和胰腺癌中表达水平很高。
2013年,在一篇Nature论文中[1],Shokat首次报道了利用小分子共价结合KRAS-G12C突变体的可行性(为了获得这类分子,其团队坚持了6年的筛选)。通过晶体学分析,Shokat等发现,共价化合物可与KRAS上先前未被发现的“开关-II口袋”(switch-II pocket)结合。
三大候选药物
这一发现立即引起了轰动。之后,Shokat与人联合创办的Araxes Pharma的子公司Wellspring Biosciences证实,Shokat所鉴定的这一化合物的改良版本可缩小被移植了携带KRAS-G12C突变的人类肿瘤的小鼠的肿瘤。不久后,Araxes与强生旗下的Janssen达成合作,致力于将这一候选药物(前文提到的JNJ‑74699157/ARS-3248)推进临床试验。
在Araxes取得进展的同时,制药巨头Amgen也有了重要收获。通过与Carmot Therapeutics合作,他们很早就发现,一些共价结合化合物甚至可以打开“开关-II口袋”的“盖子”(lid)上的一个“神秘口袋”。
“这是我们的一个关键发现。打开这一神秘口袋可能为候选分子带来更多潜在的结合位点。”Amgen研究副总裁Margaret Chu-Moyer说。(2017年,Shokat及其同事在Cell Chemical Biology杂志上报道了他们发现的同一个“神秘口袋”[2])
2018年8月,Amgen首个KRAS-G12C抑制剂(AMG510)进入临床研究,几个月后(2019年1月),竞争对手MiratiTherapeutics的KRAS-G12C抑制剂MRTX849也开始人体试验,Araxes和Janssen的JNJ-74699157在今年7月紧随其后。
Amgen公司不久前(9月)在ESMO上公布了AMG 510 I/II试验的初步数据。13例接受AMG 510治疗的NSCLC患者中,有7例(54%)患者获得了部分缓解,肿瘤体积变小;其他6例患者接受治疗后病情稳定。此外,患者似乎对AMG 510耐受良好,迄今为止未显示剂量限制毒性。目前,多例患者已经接受AMG 510治疗超过6个月。
Amgen肿瘤开发负责人GregFriberg认为,由于参与该试验的NSCLC患者病情都已恶化,且AMG 510平均是他们的四线治疗,因此,这些初步数据提示,这一KRAS-G12C抑制剂响应持久性良好。
不过,Amgen针对结直肠癌患者的试验的早期结果不算“亮眼”。12例接受治疗的患者仅1例(8%)部分缓解,剩余10例患者病情稳定。Friberg表示,不同癌种中AMG 510疗效的差异可能反应了在不同疾病中,KRAS-G12C通路起着略微不同的作用。
Mirati公司在10月于AACR-NCI-EORTC会议以及Cancer Discovery杂志上[3]公布了MRTX849相关的数据。6例可评估的NSCLC患者中,3例(50%)达部分缓解;4例结直肠癌患者中,1例(25%)达部分缓解。
联合治疗
除了单药治疗,开发者们也已在研究基于KRAS-G12C抑制剂的联合治疗。比如,安进正在研究AMG 510与PD-1抗体pembrolizumab的联合。在10月30日发表于Nature上的一篇论文中[4],相关研究者证实,10只接受这种联合策略治疗的小鼠中有9只肿瘤永久消失了。此外,被“AMG 510+pembrolizumab”治愈的小鼠之后还拥有了排斥KRAS-G12D肿瘤的能力,表明这种联合治疗可能会驱动一种获得性免疫反应。
目前,Amgen已经在NSCLC患者中测试这一联合治疗策略,且计划在今年年底在结直肠癌患者中进行测试。Mirati也计划将MRTX849与pembrolizumab联用。
除PD-1抗体,SHP2抑制剂是KRAS-G12C抑制剂开发商为它们寻找的另一“联合伙伴”。SHP2是一种磷酸酶,与KRAS的激活-失活机制有关。本月初,安进刚刚与一家名为Revolution Medicines的公司达成合作,获得其实验性SHP2抑制剂RMC-4630,不过,调查“AMG 510+ RMC-4630”的试验何时开始尚未披露。Mirati此前已与诺华达成合作,开发“SHP2抑制剂TNO155+ MRTX849”组合疗法,相关I/II期试验计划在2020年进行。
其它在研的组合策略包括“KRAS-G12C抑制剂+CDK4抑制剂”。利用全基因组CRISPR干扰筛选,Shokat团队最近发现,当KRAS被抑制时,CDK4是那些对细胞生存至关重要的基因之一。他希望,调查这一组合策略的试验尽快开始。
二、靶向其它KRAS突变体
除了KRAS-G12C抑制剂,业界在开发针对其它KRAS突变的药物方面也取得了重要进展。其中,名为ModernaTherapeutics的公司正在与默沙东合作,开发一种mRNA癌症疫苗(表1及前文提到的mRNA-5671),使其能够在体内制造抗原,以启动T细胞寻找和破坏表达四种关键KRAS突变体(G12C、G12D、G12V和G13C)的细胞。
在一项I期试验中,Moderna和默沙东正在携带KRAS突变或转移性的NSCLC、结直肠癌或胰腺癌患者中测试mRNA-5671单药治疗和“mRNA-5671+ pembrolizumab联合治疗”的潜力。
此外,如表1所示,Mirati 计划于2020年开展向FDA递交G12D抑制剂 IND申请所需的研究。
三、间接抑制KRAS
针对泛KRAS(pan-KRAS)的药物在近期也取得了令人兴奋的进展。10月末,勃林格殷格翰(BI)宣布,其首个泛KRAS抑制剂BI1701963进入临床开发阶段。BI1701963靶向的是SOS1蛋白,该蛋白可促进KRAS的激活。临床前研究表明,这种高度特异性的SOS1抑制剂可降低细胞和动物模型中KRAS-GTP水平和MAPK信号。所有的早期迹象均表明,BI1701963对KRAS激活突变有广泛的抑制作用。
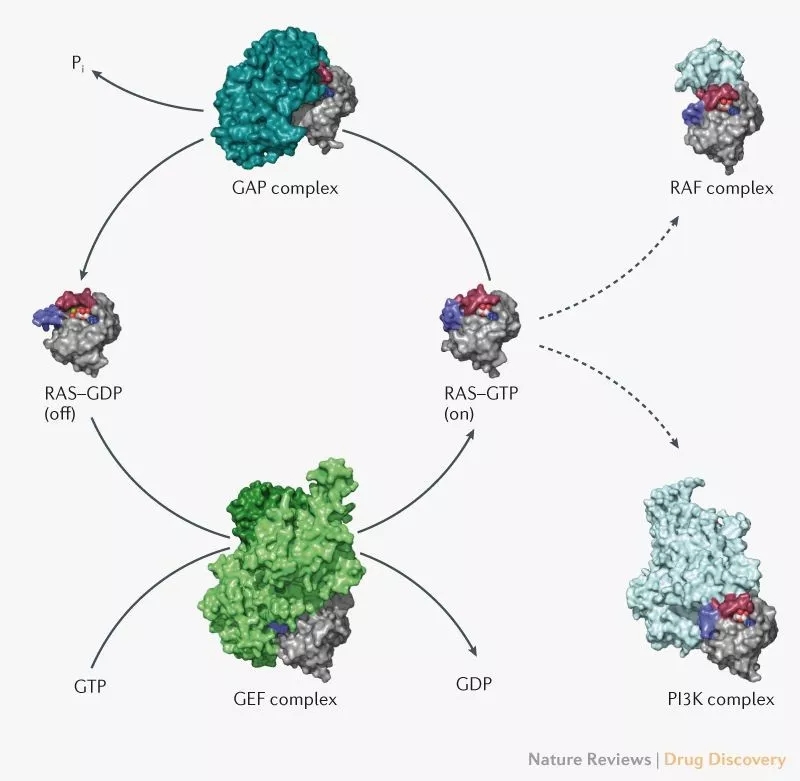
KRAS与GTP结合时处于“开启”状态,与GDP结合时处于“关闭”状态,其构象在不同状态时有所不同,这种不同调节了其结合“伙伴”的能力,如SOS1、PI3K、RAF以及GAPs.(图片来源:Nature Reviews Drug Discovery)
“与KRAS-G12C抑制剂不同,SOS1抑制剂类化合物阻断的是SOS1-KRAS的相互作用,因而与KRAS是何种突变无关。”BI癌症研究负责人Norbert Kraut解释道。
不过,BI已发现,SOS1抑制剂单药治疗效果并不突出,只能让肿瘤“停滞”,而不能杀伤肿瘤。为了获得肿瘤细胞杀死活性,他们必须将BI1701963与MEK抑制剂(trametinib)联合使用。公司期望,这种联合策略可提高疗效,并潜在的延缓适应性耐药的出现。
除BI外,今年2月,在一篇PNAS论文中[5], 拜耳也宣布,其发现了一款选择性抑制KRAS-SOS1相互作用的SOS1结合物。据称,公司正在研发SOS1抑制剂,但尚未公布任何研发时间表。
四、未来其它可能性
最后,值得一提的是,除间接抑制KRAS的SOS1抑制剂BI1701963外,BI手中还有另一款与KRAS上被新鉴定出的口袋——开关I/II口袋(switch I/II pocket)[6]结合的小分子BI-2852。研究表明,这一新发现的口袋有望为阻断KRAS与其所有“激活伙伴”(activatingpartners)、效应蛋白和失活蛋白的相互作用带来可能。BI正在积极推进结合这一口袋的化合物的研发。
鉴于过去几十年制药界对靶向KRAS的强烈渴望,相信这些新口袋的发现将进一步助长KRAS药物的研发热潮。
小结
领域:KRAS
杂志:Nature Reviews Drug Discovery
亮点:最近两年,直接或间接靶向KRAS的药物的研发取得了突破进展。目前,至少有5种KRAS调节剂处于临床开发阶段,包括三种KRAS-G12C突变体抑制剂,一种mRNA癌种疫苗以及一种SOS1抑制剂。最新发表在Nature Reviews Drug Discovery上的一篇文章详细总结了KRAS领域的近期进展,并分析了目前的竞争格局。Amgen、Mirati、Araxes/Janssen、Moderna 以及BI等公司处于领先地位。
相关论文:
[1] Jonathan M. Ostrem et al. K-Ras(G12C)inhibitorsallosterically control GTP affinity and effector interactions. Nature(2013).
[2] Daniel R. Gentile et al. Ras BinderInduces a Modified Switch-II Pocket in GTP and GDP States. Cell ChemicalBiology(2017).
[3] James G. Christensen et al. The KRASG12CInhibitor, MRTX849, Provides Insight Toward Therapeutic Susceptibility of KRASMutant Cancers in Mouse Models and Patients. Cancer Discovery(2019).
[4] Jude Canon et al. The clinicalKRAS(G12C) inhibitor AMG 510 drives anti-tumour immunity. Nature(2019).
[5] Roman C. Hillig et al. Discovery ofpotent SOS1 inhibitors that block RAS activation via disruption of theRAS–SOS1interaction. PNAS(2019).
[6] Dirk Kessler et al. Drugginganundruggable pocket on KRAS. PNAS(2019).
参考资料:
1# Cracking KRAS(来源:Nature Reviews Drug Discovery)
2# KRAS抑制剂频获突破,“不可成药”靶点将成为历史?(来源:药明康德)
3# 勃林格殷格翰将首个泛KRAS抑制剂BI1701963推进至临床试验阶段,中国将参与全球早期同步开发(来源:医药魔方)
4# Nature里程碑:KRAS抑制剂+PD-1,治愈肿瘤有希望(来源:医药魔方Pro)
(来源于:医药魔方Pro,作者曼话)


